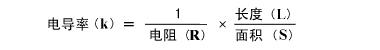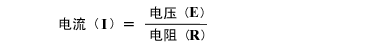电导率的测量方法
电导率怎样来测量呢?现在说一下基本的测试方法。
电解质溶液中含有离子(带有正电的阳离子和带有负电的阴离子)。现在如图(A),将一对金属板放在电解质溶液中并连接上电池。这时阳离子向电池的负极、阴离子向电池的正极移动,从而使溶液中产生了电的流动(电流)。
在施加电压以后,如图(B),离子就直接向金属板移动。这时如「1-2什么是电导率」中说明过的:
公式就成立了。也就是说如果金属板不发生变化的话,L/S就是固定的。那么电导率与电阻成反比关系。通过测量电阻,就可知道电导率的值。现在,我们再回想一下「1-1 欧姆定律」:
变形后得出R=E/I,再代入电导率的公式即可得到:
因为电池的电压(E)是固定的,电导率(k)与电流(I)就成比例关系。通过测量电流也可以求得电导率。通过此公式,我们也可以知道电导率是电流流动难易度的指标。
另外,我们在就长度与面积进行说明。
前面所说的电导率的公式中的长度(L)/面积(S)发生变化的话,测出来的电导率的值当然会发生变化。我们通常把这种长度与面积的比称为电池常数,可表示为:
原理上来讲,电极常数是一个可以通过测量金属板的间隔与面积而求得的值。当把面积为25px2的金属板以25px的间隔组合放置时,它的电极常数就是K=1/1=1(cm-1)。间隔为250px时,电极常数就变为K=10/1=10(cm-1)。在这两种放置组合中分别放入相同的液体,例如放入电导率为1(S/cm)的液体,则电极常数K=1(cm-1)时测定出的电阻为1(Ω),电极常数K=10(cm-1)时测定出电阻值10(Ω)。
以上我们所说的都是像图(B)中离子直接移动的情况。实际上离子就如其名字一样(ion是“流浪者”的意思)并不会直向金属板移动。如图(C)所示,因为也存在曲线移动的离子,这样的话电极常数是没有办法以固定的规律来求得的。那么作为解决方法,如果知道电导率并能通过测定标准液体的电阻,再由 电极常数(K)=电阻(R)*电导率(k) 就可以求得电极常数。人们经常用氯化钾(KCl)的水溶液作为标准液来使用。这些就是自奠定了电导率测定方法基础的Kohlrausch以后有关电导率测定理论的由来。
KCl校准液(JIS KO102)